Al seleccionar la opción Si, salir de Amgen.es Usted comprende que está saliendo de la página corporativa de Amgen España y que será redireccionado a otro sitio de Internet perteneciente a terceros, por cuyo contenido u opiniones Amgen España no es responsable ni hace ninguna afirmación relativa a dicho contenido o a su exactitud. Al seleccionar esta opción y acceder a sitios de terceras partes vinculados, Usted comprende que lo realiza a su propio riesgo.
El sitio de Internet al que será redirigido puede estar diseñado exclusivamente para los residentes de uno o varios países en particular, tal y como se anuncia en dicho sitio web. Como consecuencia, el sitio web al que será dirigido puede contener información de productos farmacéuticos o indicaciones que no estén aprobados en España. Si Usted reside en un país distinto al que se dirige dicha página web, por favor póngase en contacto con su filial local de Amgen para obtener la información correcta sobre productos en su país de residencia.
La información que figura en esta sección de la página web está dirigida exclusivamente al profesional sanitario facultado para prescribir o dispensar medicamentos, por lo que se requiere una formación especializada para su correcta interpretación. Los productos mencionados en la web de Amgen España pueden tener una ficha técnica autorizada diferente en otros países. La información de producto ofrecida aquí está dirigida exclusivamente a profesionales sanitarios residentes en España.
¿Quieres continuar?
A lo largo de la historia de la medicina, ha predominado el uso de compuestos químicos para la producción de fármacos de síntesis química.
Con el avance de la técnica científica, el uso de la biotecnología en la salud abrió la puerta a una nueva generación de medicamentos, los biológicos. A diferencia de los de origen químico, este tipo de fármacos son proteínas y se basan en el estudio de la biología humana.
Mientras los primeros fármacos biotecnológicos, como la insulina, eran versiones modificadas de proteínas humanas, hoy en día ya se pueden diseñar estructuras moleculares complejas gracias al estudio de la maquinaria molecular de las células y al uso de tecnologías sofisticadas.
Aprovechando todo el potencial que ofrece la ingeniería de proteínas, en Amgen investigamos la biología humana para avanzar en el desarrollo de una medicina cada vez más personalizada. En la actualidad, contamos con una sólida cartera de 12 modalidades terapéuticas distintas para dar una respuesta más amplia a muchas enfermedades graves o con necesidades de tratamiento todavía no cubiertas.
En los medicamentos de síntesis química, el principio activo es un compuesto químico, conocido también como molécula pequeña. Su tamaño es considerablemente inferior al de las moléculas biológicas, como las proteínas, y se administran por vía oral (comprimido, cápsula o solución), aunque en algunos casos también se pueden administrar con inyección o por infusión.
Gracias a su tamaño, los compuestos químicos pueden atravesar la pared celular y acoplarse a sus receptores en el interior de la célula. Asimismo, están diseñados para atravesar la barrera hematoencefálica y acoplarse a receptores objetivos relacionados con enfermedades neurológicas.
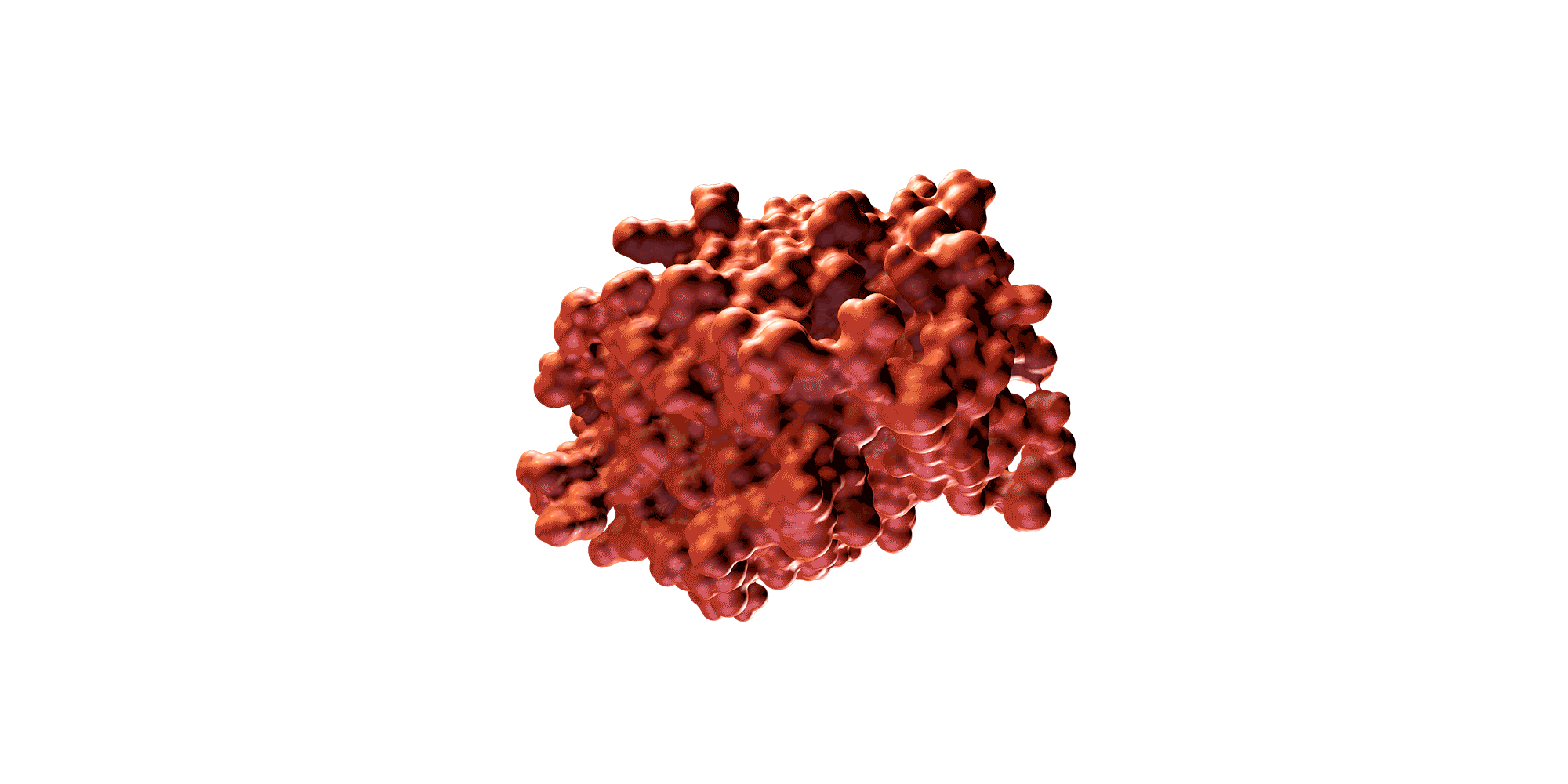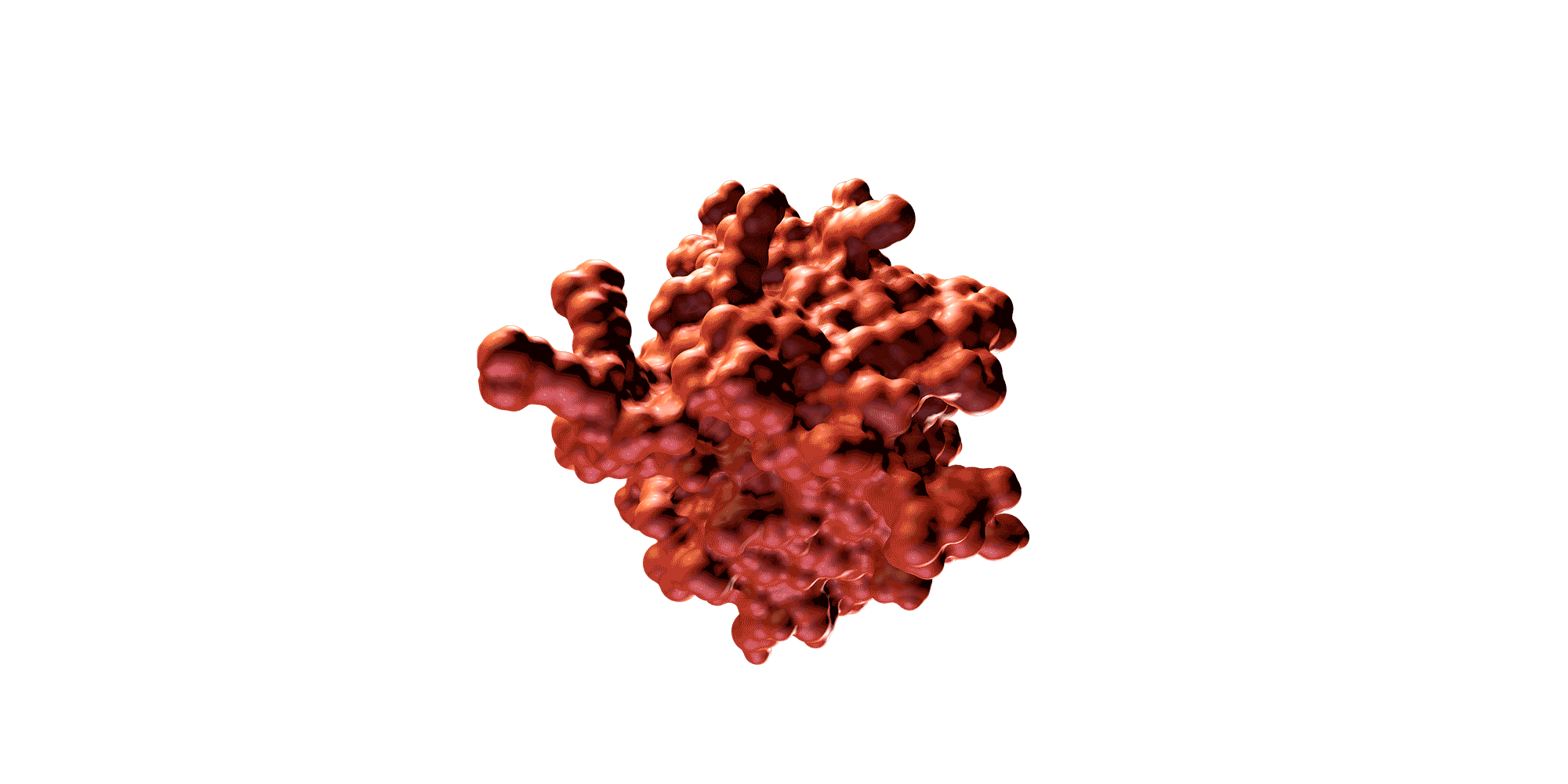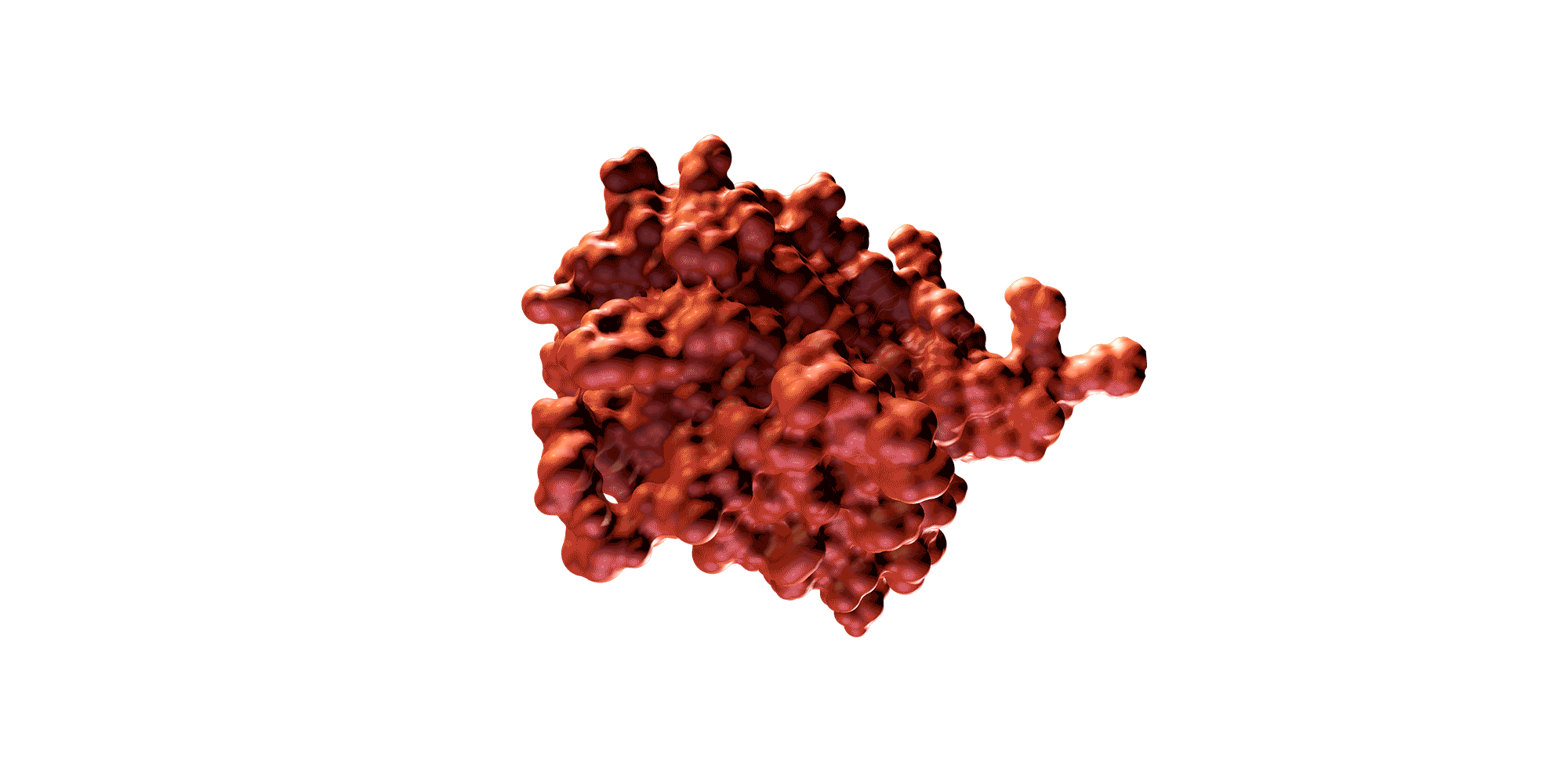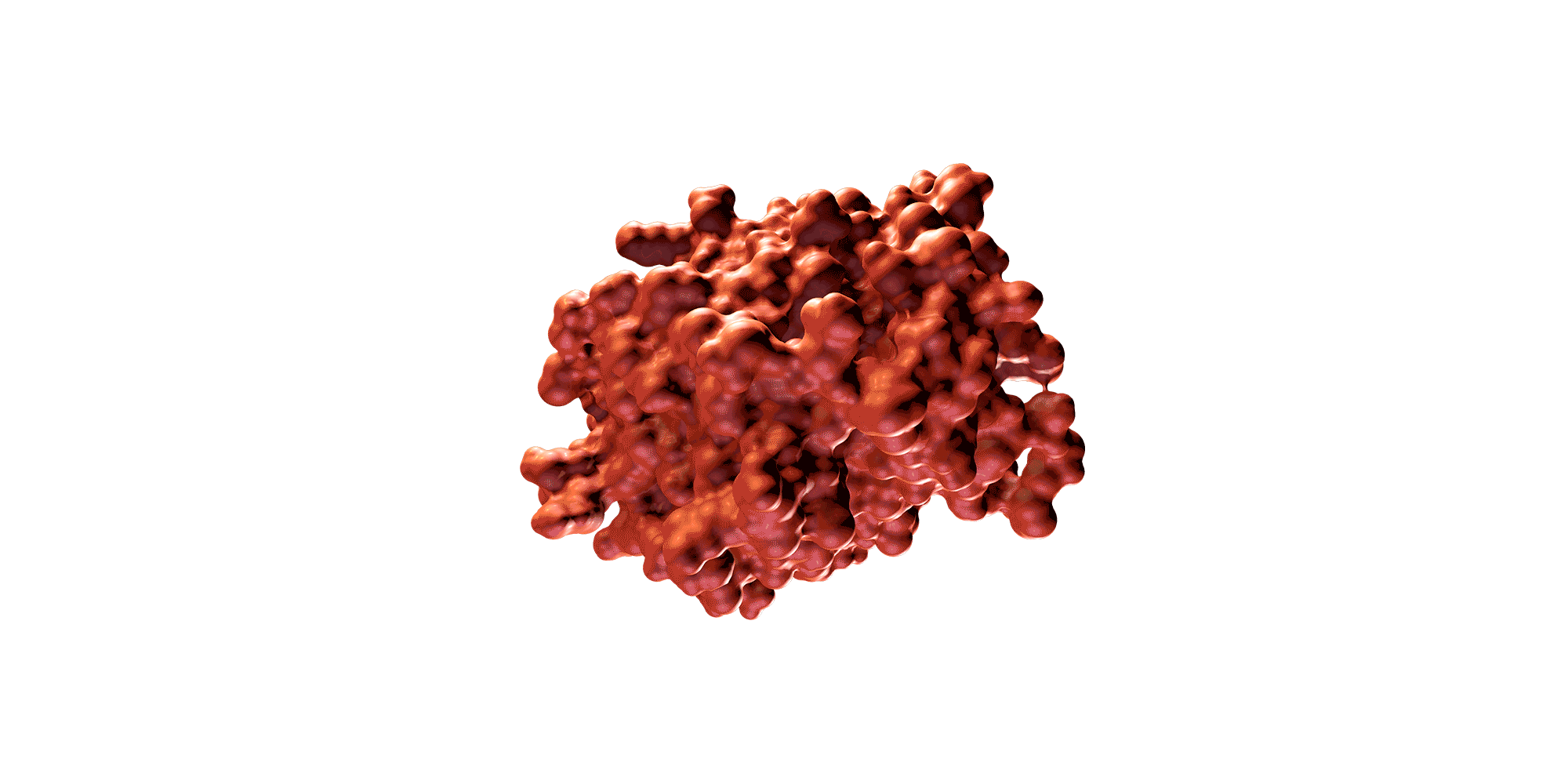
Una proteína es una molécula de gran tamaño compuesta por una larga cadena de aminoácidos y plegada de una forma tridimensional determinada. La secuencia específica de aminoácidos y la forma 3D determinan su función biológica.
Técnicamente, cualquier medicamento basado en una proteína es una proteína terapéutica. Este término se usó por primera vez para describir medicamentos desarrollados a partir de versiones manipuladas genéticamente de proteínas humanas de origen natural.
Las proteínas terapéuticas pueden utilizarse para sustituir a una proteína alterada o deficitaria en una enfermedad específica. También pueden utilizarse para asegurar el suministro de una proteína beneficiosa para el cuerpo, con la finalidad de disminuir el impacto de la enfermedad o la quimioterapia.
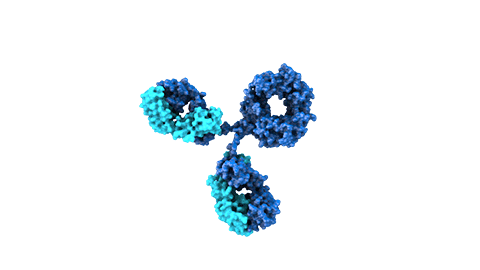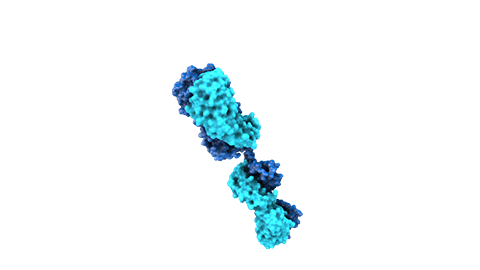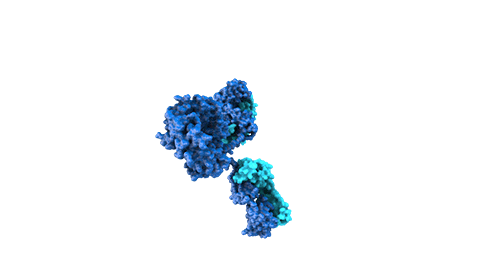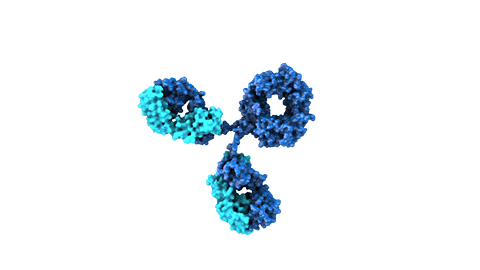
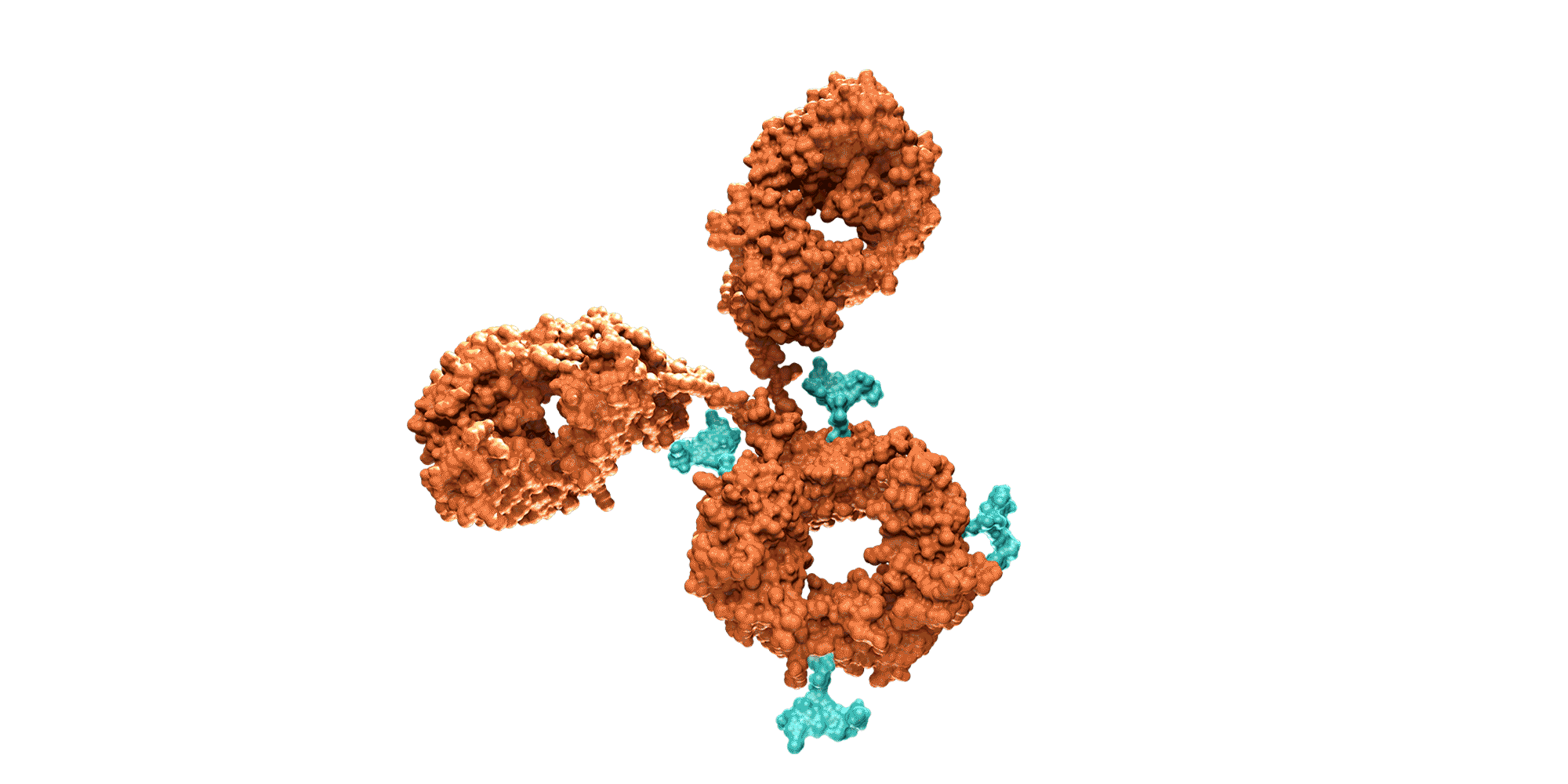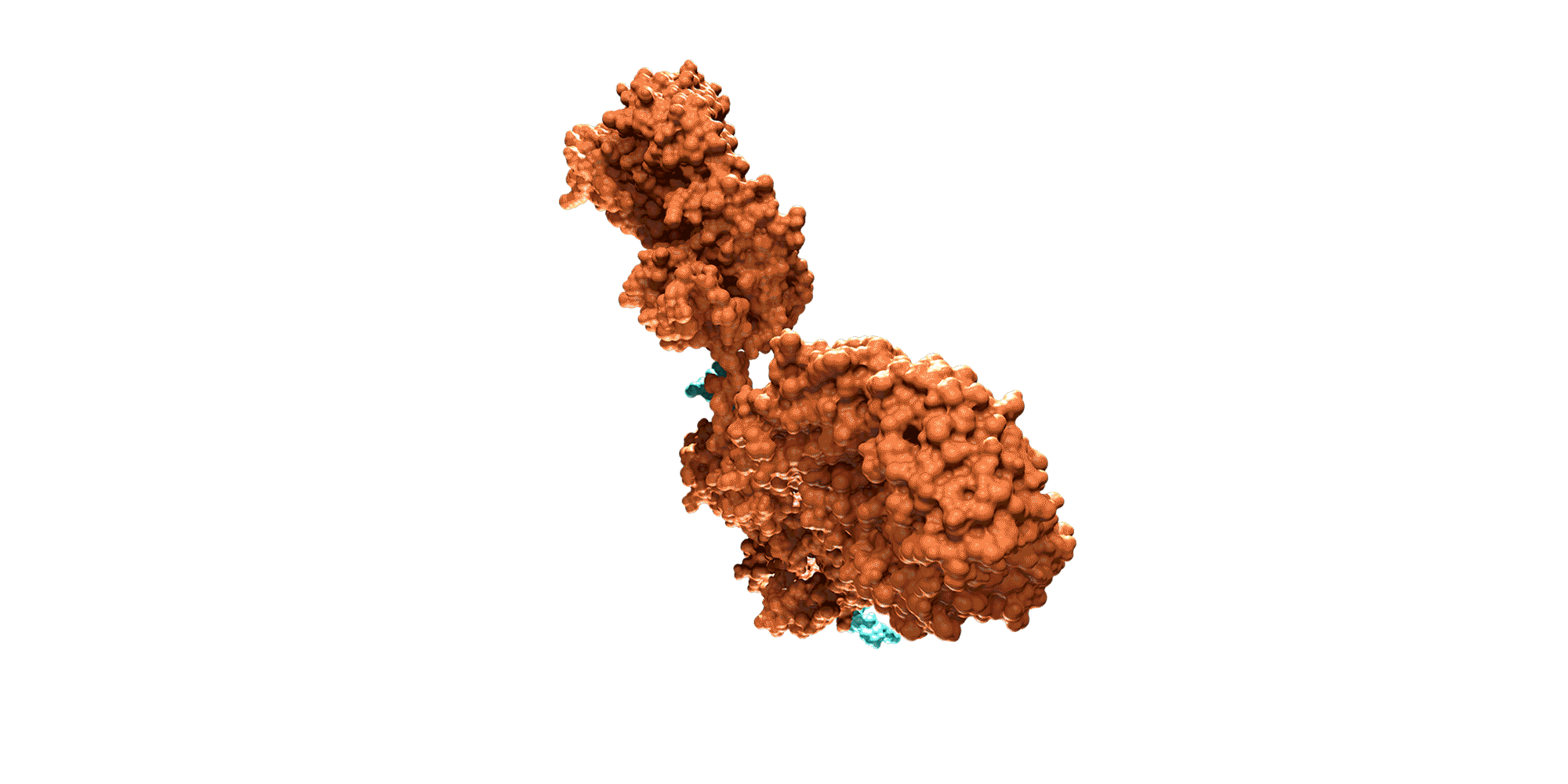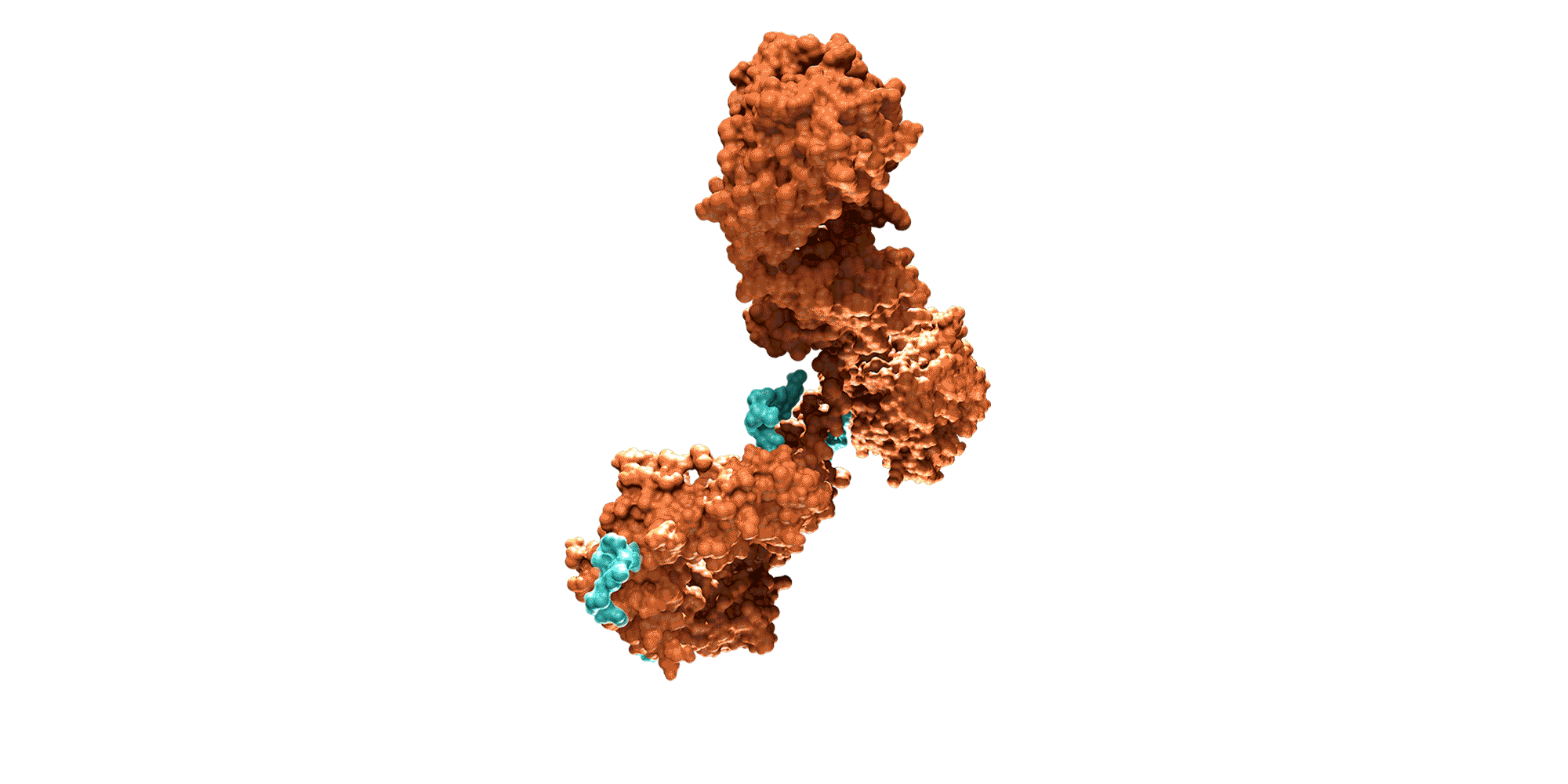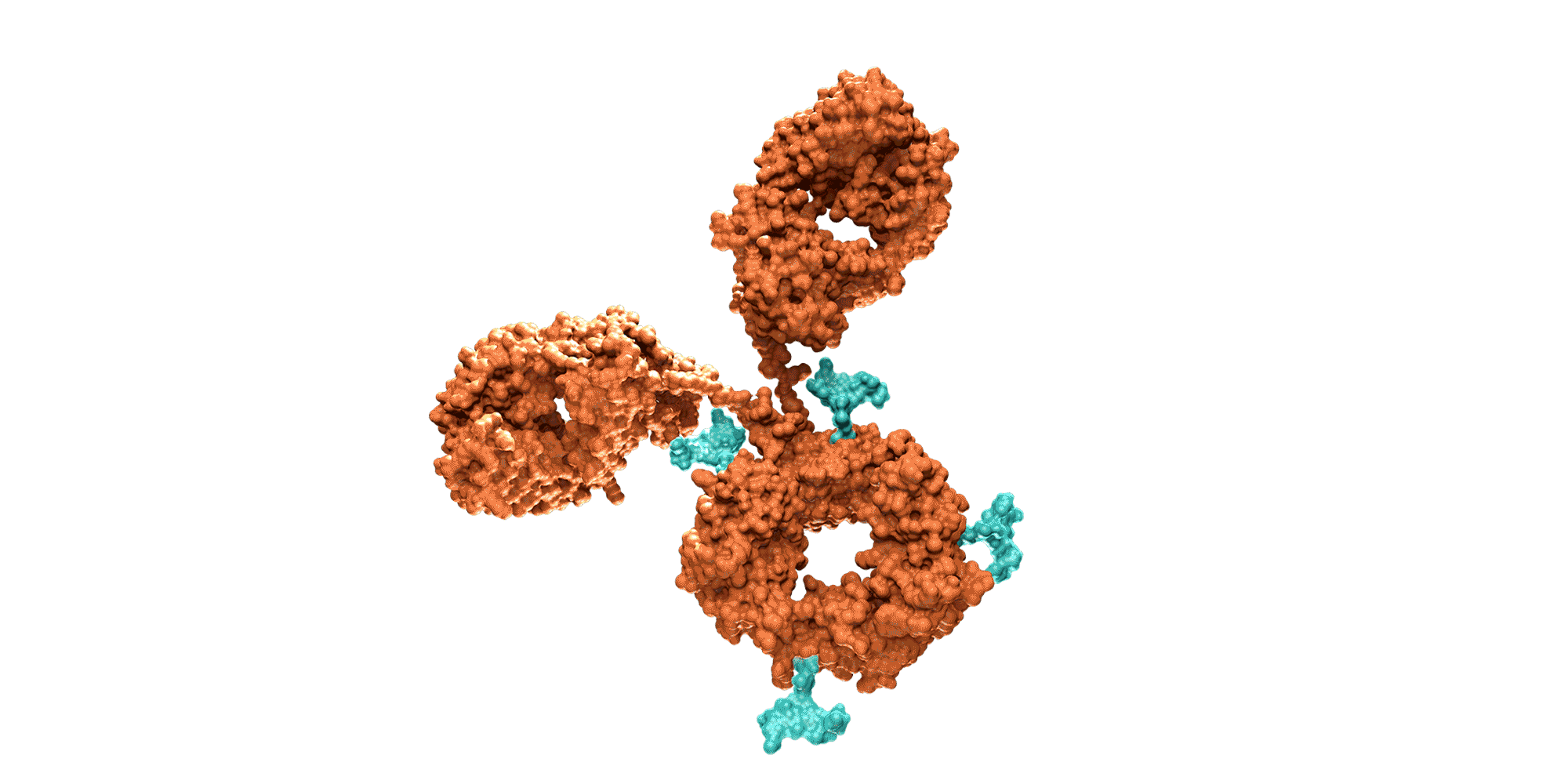
Los anticuerpos monoclonales son moléculas creadas mediante bioingeniería y diseñadas para dirigirse contra dianas proteicas específicas que intervienen en la enfermedad. Los medicamentos compuestos por esta clase de moléculas pueden dirigirse contra receptores situados fuera de las células o en la superficie celular ya que por su tamaño no siempre pueden alcanzar los receptores en el interior de las células. También suelen permanecer en el organismo más tiempo que otros fármacos, por lo que se administran con menos frecuencia.
Como sucede con los anticuerpos naturales, los monoclonales también poseen un dominio que estimula el sistema inmune (la región Fc), encargado de ayudar a organizar una respuesta inmune más extensa frente a las amenazas detectadas por los anticuerpos.
Los anticuerpos naturales actúan como uno de los principales guardianes del sistema inmune. Estas moléculas grandes en forma de Y contienen dos dominios variables (las regiones Fab), diseñadas para reconocer y unirse a antígenos específicos considerados una amenaza para el cuerpo humano. El antígeno contra el que se dirigen puede ser una proteína de un patógeno o un marcador proteico presente en células malignas o infectadas.

Las proteínas de fusión son el resultado del diseño de moléculas que contengan genes o fragmentos de genes que codifican las proteínas.
Por ejemplo, se han desarrollado varias proteínas de fusión mediante la combinación del dominio de unión de un receptor de la superficie celular con la porción de la cola (Fc) de un anticuerpo. La porción del receptor actúa como punto de unión señuelo que atrae y atrapa moléculas que, cuando son libres, contribuyen al desarrollo de la enfermedad. La porción del anticuerpo permite a la proteína de fusión permanecer en el cuerpo mucho más tiempo del que podría estar un receptor circulante por sí mismo.
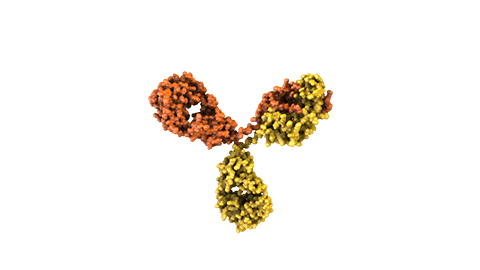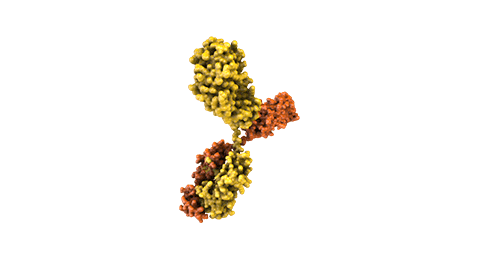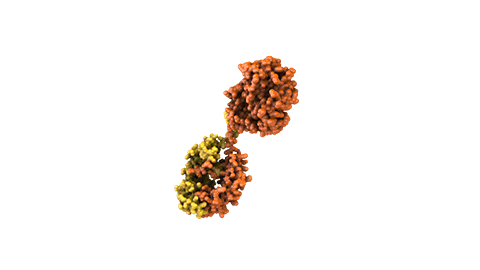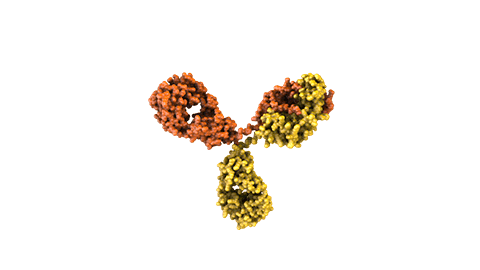
Los fármacos convencionales compuestos por anticuerpos están diseñados para dirigirse específicamente contra un solo antígeno. Sin embargo, muchas enfermedades complejas se desarrollan por numerosos factores por lo que la inhibición de un solo antígeno no lograría una eficacia suficiente. Por ejemplo, en algunas enfermedades las células responden a la inhibición de un receptor produciendo una mayor cantidad de un segundo receptor y así eluden el efecto del medicamento.
Los anticuerpos biespecíficos intentan tratar enfermedades complejas y polifacéticas. Mientras que los anticuerpos naturales tienen dos brazos para unirse a un mismo antígeno objetivo, los biespecíficos son moléculas híbridas desarrolladas mediante ingeniería que poseen dos dominios de unión diferentes dirigidos contra dos antígenos distintos.
El término péptido se aplica a proteínas pequeñas formadas por cadenas cortas de aminoácidos (alrededor de 40 o menos). El organismo utiliza una gran variedad de péptidos, que actúan como hormonas, y moléculas de señalización, que estimulan y regulan las principales vías biológicas. Algunos ejemplos muy conocidos de péptidos naturales son la insulina, las endorfinas y la somatotropina (hormona del crecimiento).
Los medicamentos peptídicos se pueden utilizar para sustituir o imitar las funciones de los péptidos naturales o para emular la capacidad de los péptidos para acoplarse a sus receptores de una manera potente y selectiva. Algunos tratamientos peptídicos se desarrollan mediante procesos químicos, mientras que otros se producen con células modificadas genéticamente.

A pesar de que los péptidos tienen funciones y atributos que les otorgan importantes propiedades terapéuticas, se eliminan rápidamente del organismo. Por eso, los medicamentos peptídicos deben administrarse mediante inyecciones diarias y lo que limita su uso a un grupo relativamente reducido de enfermedades.
fusionar un péptido con un anticuerpo o una porción de un anticuerpo, se obtiene un pepticuerpo que combina la actividad de un péptido con la actividad más duradera de un anticuerpo.
Muchos medicamentos empleados para tratar el cáncer presentan toxicidades que provocan efectos secundarios graves, limitan la dosis y la eficacia de estos fármacos y suponen una gran carga para los pacientes. Una posible forma de reducir esos problemas es mediante el uso de un conjugado anticuerpo-fármaco (CAF).
El CAF se elabora por ingeniería mediante la unión de moléculas de fármacos citotóxicos para el tratamiento del cáncer con anticuerpos o fragmentos de anticuerpos. La porción del CAF formada por un anticuerpo puede diseñarse para que se dirija contra proteínas específicas, principalmente presentes en las células tumorales.
La finalidad de este proceso es dirigir la fracción citotóxica de manera más directa a las células tumorales y reducir los daños colaterales en el tejido sano. Ambas partes del CAF (la porción dirigida y la citotóxica) se pueden modificar para ser dirigidos a una amplia variedad de tumores con diferentes medicamentos antineoplásicos.
La mayoría de fármacos actúan uniéndose a proteínas que intervienen en la enfermedad y alterando su actividad. La interferencia por ARN (iARN) es una tecnología que actúa impidiendo que las células puedan elaborar una proteína específica que contribuye al desarrollo de la enfermedad. Esta tecnología, también conocida como silenciamiento génico, se basa en los procesos naturales que utilizan las células para regular la expresión de proteínas.
La forma más habitual de iARN emplea pequeñas moléculas de ARN de interferencia (ARNip). Esas moléculas de ARN bicatenario suelen tener una longitud de 21 nucleótidos. Una vez dentro de la célula, los fragmentos de ARNip son procesados por un mecanismo formado por numerosas proteínas y se empareja con una cadena complementaria de ARN mensajero. A continuación, se degrada el ARN mensajero, con lo que se impide la producción de la proteína que codifica. Los ARNip terapéuticos contienen una secuencia altamente específica del ARN mensajero de su proteína diana. El ARNip es capaz de silenciar proteínas que son difíciles de abordar mediante otras modalidades.
Los anticuerpos acopladores biespecíficos de células T (BiTE®) son un tipo de inmunoterapia desarrollada para su uso en la lucha contra el cáncer, ya que puede ayudar al sistema inmunológico a detectar y atacar las células malignas. Los anticuerpos modificados están diseñados para interaccionar con dos tipos de células diferentes al mismo tiempo con la finalidad de yuxtaponer los linfocitos T (un tipo de glóbulo blanco capaz de eliminar otras células identificadas como amenazas) a las células cancerosas. Los anticuerpos BiTE® ayudan a ubicar los linfocitos T en una posición desde la que puedan alcanzar a las células malignas y desencadenar su destrucción (apoptosis).
Validada clínicamente para el tratamiento de la leucemia linfoblástica aguda, en Amgen empezamos a desarrollar la plataforma BiTE® en 2012 y pronto se convirtió en la inversión más importante de la compañía en el campo de la inmunoterapia. Actualmente se están testando distintas moléculas BiTE® en pacientes con linfoma no Hodgkin, linfoma difuso de célula grande B, leucemia mieloide aguda y mieloma múltiple.
La flexibilidad de esta tecnología radica en su estructura y función. Los BiTE son constructos de anticuerpos diseñados mediante ingeniería que actúan formando un puente entre una célula cancerosa y un linfocito T. La proximidad permite a los linfocitos T reconocer a las células cancerosas y destruirlas. La parte que se une a los linfocitos T es igual en todos los anticuerpos BiTE, mientras que la parte que se une al tumor es variable, de forma que pueda acoplarse a diferentes antígenos expresados en los diferentes tipos de tumores.
La mayoría de fármacos existentes para luchar contra el cáncer precisa una diana, necesaria para la supervivencia de las células cancerosas. En el caso de los BiTEs, necesitan dianas que se expresen de forma selectiva en la superficie de las células cancerosas.
La especificidad es un factor esencial del diseño del BiTE, ya que los linfocitos T son el arma más potente del sistema inmunitario. En Amgen invertimos en mejorar continuamente nuestra capacidad para identificar dianas sumamente específicas de las células cancerígenas, que no se expresen, o apenas se muestren, en la mayor parte de las células sanas. El AMG420 intenta tratar el mieloma múltiple dirigiéndose contra una proteína que se encuentra ampliamente en la superficie de estas células, la BCMA (abreviatura inglesa del antígeno de maduración de los linfocitos B).
Las CAR (receptores de antígenos quiméricos) son construcciones proteicas genéticamente modificadas que pueden incorporarse a las células T citotóxicas del propio paciente para ayudarles a reconocer y combatir a las células cancerosas.
Esta construcción proteica combina el ADN de varios genes para crear un nuevo receptor de células T que se une a los antígenos que se encuentran en las células tumorales y activa las células T como respuesta a esa unión.
La terapia con células CAR-T se realiza extrayendo o recolectando células T de un paciente con cáncer, transfectando las células con genes CAR dirigidos contra el tipo de tumor del paciente, expandiendo la población de células T modificadas y reinfundiendo las células nuevamente al paciente.
Las inmunoterapias con células T pueden incluir un dominio de unión al objetivo derivado de anticuerpo, un dominio coestimulador y un dominio activador esencial. El primer dominio tiene como objetivo hacer que las células T sean altamente selectivas para las células cancerosas. Estos últimos dominios son responsables de activar la célula T al unirse a la célula objetivo, lo que resulta en la proliferación de las células CAR T y en la destrucción directa de la célula cancerosa.
Los médicos han observado durante mucho tiempo que ciertos virus pueden retardar la progresión del cáncer. La inmunoterapia oncolítica pretende aprovechar este potencial mediante el uso de virus genéticamente modificados para atacar los tumores de dos maneras importantes y complementarias.
Al eliminar ciertos genes virales, se pueden crear virus que puedan replicarse eficazmente en células tumorales pero no en células normales. La replicación viral selectiva de tumores puede hacer que las células tumorales se lisen o se abran (oncólisis). El virus también puede modificarse para producir proteínas de señalización humana que llevan a las células inmunitarias al sitio de los tumores lisados (con células destruidas), donde se encuentran con antígenos tumorales. El objetivo es generar una respuesta inmunoterapéutica amplia que pueda ayudar a las células T citotóxicas a reconocer y atacar las metástasis tumorales a distancia en el cuerpo.
Los virus pueden aprovecharse como vectores para la inmunoterapia oncolítica. El virus se puede modificar insertando, eliminando y/o inactivando varios genes para lograr los efectos deseados, que incluyen: